PrBEPREVEMD (solution ophtalmique de bésilate de bépotastine) à 1,5 % p/v est indiqué pour le traitement de la démangeaison associée à la conjonctivite allergique.
L’innocuité et l’efficacité de BEPREVEMD n’ont pas été établies chez les enfants de moins de 3 ans.
L’efficacité de BEPREVEMD pour les enfants de moins de 10 ans a été établie par extrapolation des essais cliniques menés chez des enfants de plus de 10 ans et des adultes1.
Souhaitez-vous recevoir des échantillons de BEPREVEMD ?
Cliquez ici pour commander des échantillonsVous vous intéressez aux ressources pour les patients de BEPREVEMD ?
Cliquer ici pour accéder aux outils BEPREVEMD destinés aux patientsBEPREVEMD : un antihistaminique à double action de deuxième génération possédant plusieurs modes d’action intervenant dans la réaction allergique1†
01
02
03
04

BEPREVEMD inhibe la production d’interleukine 5 (IL-5), un facteur clé de l’activation des éosinophiles, ainsi que celle d’autres médiateurs des réactions inflammatoires et allergiques, dont le leucotriène B4 (LTB4), le leucotriène D4 (LTD4), le facteur d’activation des plaquettes (PAF) et la substance P.
BEPREVEMD affiche une activité tant dans la phase immédiate que celle tardive de la réaction allergique
BEPREVEMD : Posologie recommandée
Voir la date de péremption indiquée sur l’emballage. Ne pas utiliser BEPREVEMD après la date de péremption.

BEPREVEMD a été associé à une réduction significative des démangeaisons oculaires1†‡
Score des démangeaisons oculaires mesuré après 3 minutes de provocation conjonctivale à l’aide d’allergènes lors de la visite d’évaluation du délai d’action (moyenne des deux yeux) (paramètre d’évaluation co-primaire)2,3
La visite d’évaluation du délai d’action a nécessité 15 minutes entre l’administration du produit de recherche et le test de provocation conjonctivale à l’aide d’allergènes.
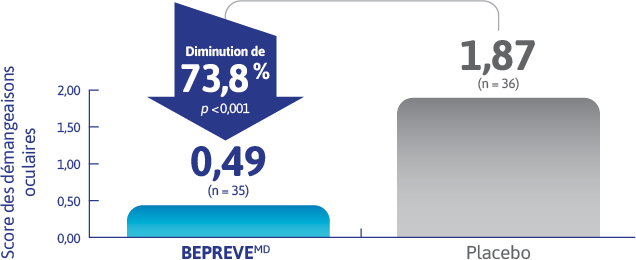
D’après Abelson et coll2,3
Différences moyennes des scores moyens de démangeaisons mesurés après 3 minutes de provocation conjonctivale à l’aide d’allergènes comparativement au placebo (paramètre d’évaluation co-primaire)1
BEPREVEMD a significativement réduit les démangeaisons oculaires après 3 minutes de la provocation conjonctivale à l’aide d’allergènes à la visite 4 (8 heures entre l’administration du produit de recherche et le test de provocation conjonctivale à l’aide d’allergènes) (différence de 1,3 unité après 3 minutes de la provocation conjonctivale à l’aide d’allergènes; p < 0,0001)*.*

* La visite 3B a nécessité 16 heures entre l’administration du produit de recherche et le test de provocation conjonctivale à l’aide d’allergènes.
La visite 4 a nécessité 8 heures entre l’administration du produit de recherche et le test de provocation conjonctivale à l’aide d’allergènes.
La visite 5 a nécessité 15 minutes entre l’administration du produit de recherche et le test de provocation conjonctivale à l’aide d’allergènes.
D’après la monographie du produit 1
L’efficacité a été établie lors d’essais cliniques de phase 2/3 ou de phase 3, contrôlés par placebo, à répartition aléatoire et à double insu par des tests de provocation conjonctivale à l’aide d’allergènes. Les patients ont été regroupés aléatoirement pour recevoir BEPREVEMD à 1,5 % p/v ou le placebo. Les tests de provocation conjonctivale ont été réalisés à l’aide de multiples allergènes saisonniers et apériodiques. Les participants à l’étude comprenaient des sujets masculins et féminins de 10 ans et plus ayant des antécédents positifs de conjonctivite allergique. Les démangeaisons oculaires [mesurées sur une échelle de 5 allant de 0 (aucune) à 4 (démangeaison incapacitante s’accompagnant d’une envie irrésistible de se frotter les yeux)] ont été évaluées après 3, 5 et 7 minutes de la provocation conjonctivale à l’aide d’allergènes1.
BEPREVEMD a démontré une signification clinique en termes de réduction des démangeaisons oculaires pour le délai d’action à partir de 3 minutes et pour la durée d’action sur 8 heures des tests de provocation conjonctivale à l’aide d’allergènes. La signification clinique était définie comme le changement de plus d’une unité sur l’échelle de classement à une majorité des points d’évaluation dans le temps1,2.
BEPREVEMD a démontré un profil d’innocuité et de tolérabilité bien établi1§
Incidence des effets indésirables liés au traitement survenus chez > 1 % des patients
| Classe de système d’organes¶ | BEPREVEMD à 1,5 % p/v (n = 653) n (%) |
Placebo (n = 365) n (%) |
|---|---|---|
| Troubles oculaires | ||
| Irritation des yeux | 29 (4,4) | 10 (2,7) |
| Troubles du système nerveux | ||
| Altération du goût†† | 88 (13,5) | 4 (1,1) |
| Goût désagréable†† | 45 (6,9) | 1 (0,3) |
| Céphalée | 18 (2,8) | 6 (1,6) |
| Arrière-goût | 14 (2,1) | 2 (0,5) |
La majorité des effets indésirables ont été légers et transitoires et aucun patient n’a éprouvé un effet indésirable grave.
BEPREVEMD a été généralement bien toléré
Autres paramètres d’évaluation de l’innocuité sélectionnés1
Aucune constatation significative sur le plan clinique n’a été faite lors des autres évaluations de l’innocuité (acuité visuelle, PIO, microscopie à la lampe à fente, examen du fond de l’œil avec pupille dilatée, numérations des cellules endothéliales)
Aucune différence cliniquement significative sur le plan du confort oculaire lors de l’instillation entre les groupes recevant BEPREVEMD et les groupes témoins‡‡
L’innocuité et la tolérabilité ont été déterminées chez 653 sujets qui ont été exposés à la solution ophtalmique de bésilate de bépotastine à 1,5 % p/v lors de 3 études cliniques menées aux É.-U.1.
Les classes de systèmes d’organes et les termes préférentiels ont été codés selon la version 9.1 de MedDRA pour ISTA-BEPO-CS01, et selon la version 10,1 de MedDRA pour CL-S&E-0409071-P et CL-SAF-0405071-P1.
Terme de niveau inférieur. La version 9.0 de MedDRA codifie tous les effets indésirables liés au goût sous le terme préférentiel « dysgueusie ». Selon de nombreux dictionnaires médicaux, la dysgueusie se définit comme une dégradation, une distorsion, le dysfonctionnement ou une altération du sens du goût. Par conséquent, la dysgueusie est un terme inexact pour décrire le goût d’un produit de recherche, car il fait référence à une subversion des sens du goût et non à la qualité du goût inhérent au produit de recherche1.
Le confort oculaire a été évalué sur une échelle de 4, où 0 = confortable et 3 = fortement inconfortable1.
Résumé
BEPREVEMD :
A démontré une signification en termes de réduction des démangeaisons oculaires pour le délai d’action à partir de 3 minutes et pour la durée d’action sur 8 heures et sur 16 heures des tests de provocation conjonctivale à l’aide d’allergènes
A été généralement bien toléré
- L’effet indésirable le plus fréquemment signalé chez environ 13,5 % des sujets traités par BEPREVEMD était une légère altération transitoire du goût
- Les autres effets indésirables ont été le goût désagréable (6,9 %), l’irritation des yeux (4,4 %), la céphalée (2,8 %) et l’arrière-goût (2,1 %)
- A été principalement associé à des effets indésirables légers et transitoires

Références :
1. Monographie de BEPREVE. Bausch & Lomb Incorporated. 22 juillet 2016.
2. Abelson MB et coll. Time to onset and duration of action of the antihistamine bepotastine besilate ophthalmic solutions 1.0% and 1.5% in allergic conjunctivitis: A phase III, single-center, prospective, randomized, double-masked, placebo-controlled, conjunctival allergen challenge assessment in adults and children. Clin Ther 2009;31:1908–21.
3. Données internes, Bausch & Lomb Incorporated, 2017.


